
 | |
|
Главная
>
Выпрямитель преобразовывающий ток Аккумуляторы этого типа значительно легче и меньше по объему (в 4-6 раз), чем кислотные и шелочные. К достоинствам СЦ аккумуляторов следует отнести их малый саморазряд и возможность кратковременного разряда токами, в сотни.раз превышающими номинальное значение. Аккумуляторы этого типа нормально работают в диапазоне температур от -30 до --70°С и характеризуются высокой отдачей по емкости (до 100%) и по энергии (до 85%). Основным недостатком СЦ аккумуляторов является их высокая стоимость. 7.4. ТОПЛИВНЫЕ ЭЛЕМЕНТЫ Топливный элемент относится к химическим источникам тока и представляет собой гальванический элемейт, в котором реагенты (топливо и окислитель) непрерывно поступают извне к электродам, помещенным в электролит. Электрическая энергия в топливных элементах, как и в тепловых машинах с электромеханическими преобразователями энергии, получается в результате реакции окисления топлива. В отличие от тепловой машины в топливном элементе окисление горючего и восстановление окислителя происходят на отрицательном и положительном электродах электрохимическим путем, - при этом энергия химической реакции выделяется непосредственно в виде электрической энергии. Таким образом, в топливном элементе происходит непосредственное преобразование химической энергии в электрическую. Для непосредственного превращения химической энергии в электрическую обязательным является управление движением электронов, т. е. создание условий, при которых электроны будут двигаться в нужном направлении с определенной скоростью. Управление движением электронов при протекании химической реакции в топливном элементе достигается за счет разъединения реакции на две части. На отрицательном электроде происходит разделение молекул горючего на атомы и срыв электронов с электронных оболочек. Свободные электроны скапливаются на электроде, и он приобретает отрицательный потенциал. На положительном электроде происходи .. раде- ление молекул окислителя на атомы и присоединение к ним свободных электронов. Так как электроды обл!-дают разными потенциалами, то при включении их во внешнюю цепь по цепи потечет электрический ток. Од постороннее направленнос движение электронов но внешней цепи возможно только при компенсирующее это движение перемещении ионов в растворе электролп та, в котором помещены электроды. 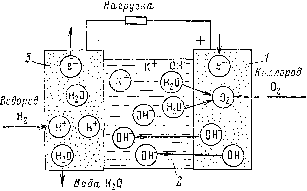 Рис. 7.4. Схема водородно-кислородного топливного элемента. ) -кислородный электрод (катод); 2 - раствор электролита (КОН); 3 - водородный электрод (анод). На рис. 7.4 изображена схема водородно-кислородного топливного элемента. В водородно-кислородном топливном элементе имеются два электрода (положитель ный и отрицательный), помещенные в щелочной элект ролит (КОН). К отрицательному электроду подводится водород, к положительному - кислород. Продукт окчс ления водорода (вода HgO) во время реакции отводите;! от топливного элемента. Электроды в топливных элементах выполняются пористыми. Подведенный к отрицательному электроду водород адсорбируется на сухой стороне электрода, диссоциирует благодаря каталическому действию электрода до Н, и атомы Н поглощаются электродом за счет химической реакции с металлом электрода, образуя Ме-Н. Затем атомы водорода диффундируют к границе трех фаз (электролит - электрод - водород) и переходят в элек- тролит, оставляя на электроде по одному электрону согласно следующей реакции: Me - Н -f 0Н--1%0 + Me + ё. Суммарная реакция на отрицательном (водородном) электроде + 20Н--4Н20 -Ь 4 ё. На положительном электроде кислород адсорбируется, диссоциирует под действием катализатора до О, атомы кислорода диффундируют к границе трех фаз и переходят в электролит с захватом двух элементарных зарядов, образуя отрицательные ионы согласно реакции Me - О + 2е + НО-Ме + 20Н-. Суммарная реакция на положительном (кислородном) электроде Оа + 2Н2О + 4ё->40Н-, Отрицательные ионы ОН проходят через электролит к отрицательному электроду, где соединяются с положительными ионами водорода, образуя воду. Суммарное уравнение токообразующего процесса в кислородно-водородном топливном элементе имеет следующий вид: 2Н, -f О, = 2Н.,0 + Qp, где Qp - тепловой эффект реакции. Для того чтобы данный процесс шел непрерывно, необходимо постоянно подводить топливо (Н2) и окислитель (О2) и отводить продукты реакции (Н2О). Водородный и кислородный электроды изготавливают из никеля, в качестве катализатора применяют соответственно никель, рений и серебро. Электроды выполняют двухслойными, причем слой, прилегающий к газу, должен быть крупнопористым, а слой, прилегающий к электролиту, - мелкопористы.м. Батарея топливных элементов с вспомогательными устройствами - насосом для-подачи топлива, теплообменником, холодильником, резервуарами для хранения топлива и т. д. - называется электрохимическим генератором (ЭХГ). В случае, если окислителем ЭХГ служит кислород воздуха или чистый кислород, в качестве топлива можно
|